【ket qua hạng nhất anh】Thêm 5 thuốc nội nhận giấy đăng ký lưu hành
Danh sách 5 thuốc gồm: Pharcavir,êmthuốcnộinhậngiấyđăngkýlưuhàket qua hạng nhất anh Zacutas 60, Zacutas 90, Dactasvir 30mg, Dactasvir 60mg, lần lượt có số đăng ký từ VD3-29-19 đến VD3-34-19.
Cục quản lý Dược yêu cầu cơ sở sản xuất và cơ sở đăng ký thuốc có trách nhiệm sản xuất thuốc theo đúng các hồ sơ, tài liệu đã đăng ký với Bộ Y tế và phải in số đăng ký được Bộ Y tế Việt Nam cấp lên nhãn thuốc.
Đồng thời thực hiện việc cập nhật tiêu chuẩn chất lượng của thuốc theo quy định. Cập nhật nhãn thuốc, tờ hướng dẫn sử dụng thuốc theo quy định tại Thông tư số 01/2018 trong thời hạn 6 tháng kể từ ngày ký ban hành Quyết định này, theo hình thức thay đổi, bổ sung giấy đăng ký lưu hành thuốc quy định tại Thông tư số 32/2018/TT-BYT ngày 12/11/2018 của Bộ trưởng Bộ Y tế quy định việc đăng ký lưu hành thuốc, nguyên liệu làm thuốc.
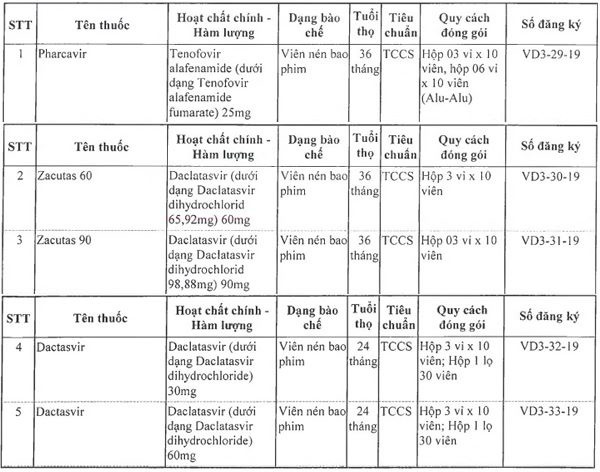 |
| Danh sách 5 thuốc mới được cấp giấy đăng lý lưu hành |
Đối với thuốc Pharcavir chứa hoạt chất tenofovir alafenamide fumarate (thuốc số 1 tại danh mục) phải cập nhật tờ hướng dẫn sử dụng theo tờ hướng dẫn sử dụng thuốc Vemlidy đã được Cơ quan Quản lý Dược Châu Âu (EMA) phê duyệt trong thời hạn 03 tháng kể từ ngày ký ban hành Quyết định này và chỉ được sản xuất, lưu hành sau khi được Cục Quản lý Dược phê duyệt nội dung này.
Các có sở sản xuất cần phối hợp với các cơ sở điều trị để thực hiện theo đúng các quy định hiện hành về thuốc kê đơn, theo dõi an toàn, hiệu quả, tác dụng không mong muốn của thuốc trên người Việt Nam.
Cơ sở đăng ký thuốc phải bảo đảm duy trì điều kiện hoạt động trong thời gian hiệu lực của giấy đăng ký lưu hành thuốc, nguyên liệu làm thuốc. Trong trường hợp không còn đáp ứng đủ điều kiện hoạt động, cơ sở đăng ký phải có trách nhiệm thực hiện thay đổi cơ sở đăng ký.
Đối với thuốc số thứ tự 02, 03, 04, 05 (chứa hoạt chất daclatasvir dihydrochlorid) tại Danh mục ban hành kèm theo Quyết định này, cơ sở phải gửi mẫu thuốc kèm theo chất chuẩn đối với 03 lô sản xuất đầu tiên để Viện Kiểm nghiệm thuốc Trung ương hoặc Viện Kiểm nghiệm thuốc TP.HCM kiểm tra theo tiêu chuẩn chất lượng đã đăng ký, chỉ được lưu hành sau khi kết quả kiểm nghiệm đạt yêu cầu.
T.Thư
(责任编辑:World Cup)
- ·Không đăng ký dịch vụ, vẫn bị nhà mạng trừ tiền
- ·Cân nhắc mở rộng đối tượng được tiếp cận thông tin người nhiễm HIV
- ·Hải Phòng lập 6 chốt kiểm soát dịch Covid
- ·Từ 0h ngày 14/8, thành phố Hải Dương cách ly xã hội trong 15 ngày
- ·Hà Nội tặng 2 tỷ đồng cho đội tuyển bóng đá nam Việt Nam
- ·Cục Điều tiết điện lực xin rút lại các phương án điện 1 giá
- ·Tập đoàn Panko Hàn Quốc muốn làm khu đô thị và sân golf tại Quảng Nam
- ·Bắc Bộ tiếp tục mưa to đến rất to, nguy cơ xảy ra lũ quét
- ·Sửng sốt với loài ốc quý hiếm nhất thế giới được tìm thấy sau 31 năm
- ·Quảng Ngãi cũng có bệnh nhân Covid
- ·Tránh rủi ro cho màn hình của Galaxy S8 và S8 Plus
- ·Nghệ An mời đầu tư khu đô thị rộng hơn 20 ha, trị giá 1.400 tỷ đồng
- ·Chi bộ khu vực An Hưng làm theo Bác
- ·Đà Nẵng: Bệnh nhân Covid
- ·Từ chối trả thưởng vé số trúng giải đặc biệt bị rách, công ty xổ số nói gì?
- ·Đảng bộ Khối doanh nghiệp tỉnh Thái Bình tổ chức thành công Đại hội lần thứ IV
- ·Bà Rịa – Vũng Tàu tạm dừng đấu giá 71 lô đất tại huyện Đất Đỏ
- ·Huyện Bàu Bàng: Xử phạt 10 trường hợp vi phạm hành chính về môi trường
- ·HCM City's master planning scheme embodies innovative thinking, bold ambitions: PM
- ·Ngành đường sắt áp dụng quy định mới về vận tải hành lý của hành khách













